Dentro de una molécula, los átomos están unidos mediante
fuerzas intramoleculares (enlaces iónicos, metálicos o covalentes,
principalmente). Estas son las fuerzas que se deben vencer para que se
produzca un cambio químico. Son estas fuerzas, por tanto, las que determinan
las propiedades químicas de las sustancias.
Sin embargo existen otras fuerzas intermoleculares
que actúan sobre distintas moléculas o iones y que hacen que éstos se
atraigan o se repelan. Estas fuerzas son las que determinan las propiedades
físicas de las sustancias como, por ejemplo, el estado de agregación,
el punto de fusión y de ebullición, la solubilidad, la tensión superficial,
la densidad, etc.
Por
lo general son fuerzas débiles pero, al ser muy numerosas, su contribución
es importante. La figura inferior resume los diversos tipos de fuerzas
intermoleculares.

Fuerzas ion-ion

Son
las que se establecen entre iones de igual o distinta carga:
- Los iones con cargas de signo opuesto se atraen
- Los iones con cargas del mismo signo se repelen
Con frecuencia, este tipo de interacción recibe el nombre de puente salino. Son frecuentes entre una enzima y su sustrato, entre los aminoácidos de una proteína o entre los ácidos nucleicos y las proteínas.
Fuerzas ion-dipolo


Son las que se establecen entre un ión y una
molécula polar.
Por ejemplo, el NaCl se disuelve en agua por la
atracción que existe entre los iones Na+ y Cl-
y los correspondientes polos con carga opuesta de la molécula de
agua. Esta solvatación de los iones es capaz de vencer las
fuerzas que los mantienen juntos en el estado sólido (Figura inferior
izquierda).
La capa de agua de hidratación que se forma
en torno a ciertas proteínas y que resulta tan importante para su
función también se forma gracias a estas interacciones.
Fuerzas ion-dipolo inducido
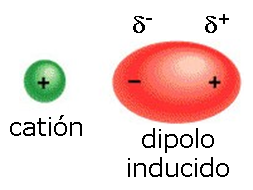
Tienen lugar entre un ión y una molécula apolar.
La proximidad del ión provoca una distorsión en la nube electrónica de
la molécula apolar que convierte (de modo transitorio) en una molécula
polarizada. En este momento se produce una atracción entre el ión y la
molécula polarizada.
Un ejemplo de esta interacción es la interacción entre
el ión Fe++ de la hemoglobina y la molécula de O2,
que es apolar. Esta interacción es la que permite la unión
reversible del O2 a la hemoglobina y el transporte de O2
desde los pulmones hacia los tejidos.
Interacciones hidrofobicas

En un medio acuoso, las moléculas hidrofóbicas tienden
a asociarse por el simple hecho de que evitan interaccionar con el agua.
Lo hace por razones termodinámicas: las moléculas hidrofóbicas
se asocian para inimizar el número de moléculas de agua
que puedan estar en contacto con las moléculas hidrofóbicas.
Fuerzas de van der waals


Cuando
se encuentran a una distancia moderada, las moléculas se atraen entre
sí pero, cuando sus nubes electrónicas empiezan a solaparse, las moléculas
se repelen con fuerza
El término "fuerzas de van der Waals"
engloba colectivamente a las fuerzas de atracción entre las moléculas.
Son fuerzas de atracción débiles que se establecen entre moléculas eléctricamente
neutras (tanto polares como no polares), pero son muy numerosas y desempeñan
un papel fundamental en multitud de procesos biológicos.
- Fuerzas dipolo-dipolo (también llamadas fuerzas de Keesom), entre las que se incluyen los puentes de hidrógeno
- Fuerzas dipolo-dipolo inducido (también llamadas fuerzas de Debye)
- Fuerzas dipolo instantáneo-dipolo inducido (también llamadas fuerzas de dispersión o fuerzas de London).
Fuerzas dipolo-dipolo
Una molécula es un dipolo cuando existe una distribución
asimétrica de los electrones debido a que la molécula está formada
por átomos de distinta electronegatividad. Como consecuencia de
ello, los electrones se encuentran preferentemente en las proximidades
del átomo más electronegativo. Se crean así dos regiones (o polos) en
la molécula, una con carga parcial negativa y otra con carga parcial positiva.
Cuando dos moléculas polares (dipolos) se aproximan, se produce una atracción entre el polo positivo de una de ellas y el negativo de la otra. Esta fuerza de atracción entre dos dipolos es tanto más intensa cuanto mayor es la polarización de dichas moléculas polares o, dicho de otra forma, cuanto mayor sea la diferencia de electronegatividad entre los átomos enlazados.
Cuando dos moléculas polares (dipolos) se aproximan, se produce una atracción entre el polo positivo de una de ellas y el negativo de la otra. Esta fuerza de atracción entre dos dipolos es tanto más intensa cuanto mayor es la polarización de dichas moléculas polares o, dicho de otra forma, cuanto mayor sea la diferencia de electronegatividad entre los átomos enlazados.
Puente de hidrogeno

Los
puentes de hidrógeno constituyen un caso especial de interacción
dipolo-dipolo (Figura de la derecha). Se producen cuando un átomo
de hidrógeno está unido covalentemente a un elemento que sea:
- muy electronegativo y con dobletes electrónicos sin compartir
- de muy pequeño tamaño y capaz, por tanto, de aproximarse al núcleo del hidrógeno.
Furzas dipolo-dipolo inducido.

Tienen lugar entre una molécula polar y una molécula
apolar. En este caso, la carga de una molécula
polar provoca una distorsión en la nube electrónica de la molécula apolar
y la convierte, de modo transitorio, en un dipolo. En este momento se
establece una fuerza de atracción entre las moléculas.
Fuerzas dipolo instantaneo-dipolo induciodo.
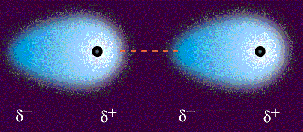
También se llaman fuerzas de dispersión
o fuerzas de London. En muchos textos, se identifican con las fuerzas
de van der Waals, lo que puede generar cierta confusión.
Las fuerzas de dispersión son fuerzas atractivas débiles
que se establecen fundamentalmente entre sustancias no polares, aunque
también están presentes en las sustancias polares. Se deben a las irregularidades
que se producen en la nube electrónica de los átomos de las moléculas
por efecto de la proximidad mutua. La formación
de un dipolo instantáneo en una molécula origina la formación de
un dipolo inducido en una molécula vecina de manera que se origina
una débil fuerza de atracción entre las dos.
No hay comentarios:
Publicar un comentario